通讯:13983250545
微信:ycsh638
QQ:469764481邮箱:ycsh6318@163.com
一种雷氏放射孢子虫的鉴定及其特征描述
一种雷氏放射孢子虫的鉴定及其特征描述
翟艳花1,2周 莉1桂建芳1
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
放射孢子虫(Actinosporean)是黏体动物在其中间宿主水生无脊椎动物体内的一个生活阶段。研究鉴定并描述了一种雷氏放射孢子虫的形态和分子特征。该放射孢子虫的主要形态结构是: 由三个极囊、内含孢原质的孢子体和三个尾突组成, 无孢柄。极囊位于孢子体顶端, 呈梨形, 长5.2 μm, 宽2.9 μm; 孢子体侧面观呈长椭圆形, 长16.4 μm, 宽9.5 μm; 三个尾突基本等长, 呈锚状, 平均长度102.6 μm, 宽9.54 μm, 尾突末端轻微的上翘。每个尾突远侧端表面有许多形状不规则的棘状小刺。18S rDNA序列比对表明, 该雷氏放射孢子虫与国外已报道的Myxobolus cultus 18S rDNA序列一致性最高, 达98.41%, 由此推测该雷氏放射孢子虫可能为M. cultus的对应放射孢子虫阶段。研究丰富了国内放射孢子虫的基础研究。
黏体动物; 雷氏放射孢子虫; 苏氏尾鳃蚓
黏体动物(Myozoans)是一类多细胞、形成孢子的后生动物寄生虫, 广泛寄生于多种重要的经济鱼类, 迄今已报道了2180种[1]。黏孢子虫几乎能在鱼体的所有器官中寄生, 可夺取宿主营养、分泌可溶解宿主组织的酶以及造成机械性损伤与压迫等伤害,轻者影响鱼体生长发育, 使商品鱼丧失应有的价值,重者可直接造成感染鱼的大量死亡, 给水产养殖业带来巨大的经济损失和生态影响[2—4]。
放射孢子虫(Actinosporean), 原隶属于黏体动物门(Phylum Myxozoa)放射孢子虫纲(Class Actinomyxidia), 首次被Stolc[5]作为一种寄生于无脊椎动物体内的寄生虫被记录之后, 曾长期被认为是黏体动物门下的一个独立的生物种群。1984 年, Wolf 和Markiw对引起虹鳟“旋转病”(Whirling disease, WD)病原体脑黏体虫(M. cerebralis)的生活史进行了研究,首次证实脑黏体虫的生活史包括鱼和寡毛类(Tubifex tubifex)两个宿主, 放射孢子虫只是黏体动物在水生无脊椎动物体内的一个生活阶段[6]。从此,国际上将原隶属于黏体动物门下的放射孢子虫纲取消, 将其中的各类型放射孢子虫物种暂时以“组合群”(Collect groups)作为过渡分类单位而归入黏孢子虫纲[1,7]。由于放射孢子虫对宿主个体的强感染力引起了广大研究者的重视。各国学者对放射孢子虫展开了多方面的研究, 主要涉及放射孢子虫新类型的鉴定、超微结构观察、系统发育等[8—10]。但我国开展的相关研究较少, 除了王桂堂和姚卫建[11]鉴定的一种三突放射孢子虫以及我们鉴定的另一种新的三突放射孢子虫类型[12]之外, 未见其他相关文献报道。
异育银鲫是近十多年来养殖规模和养殖产量稳步持续增长的淡水养殖鱼类之一, 近年来与其他鲫鱼一起年总产量已突破200万吨, 产值近300多亿元, 在淡水养殖中占据十分重要的地位[13,14]。目前,寄生虫病, 尤其是黏孢子虫病引起的病害已成为制约鲫鱼养殖业发展的一个重要因素[15—17]。调查并鉴定放射孢子虫或黏孢子虫将有助于鲫鱼养殖业的健康持续发展。因此, 我们对位于武汉蔡甸实验基地内常年暴发黏孢子虫病的异育银鲫养殖池塘进行了连续的调查研究, 采集池塘底泥中的水生环节动物,对其释放出的放射孢子虫进行形态学和分子学研究。本研究报道其中鉴定的一种雷氏放射孢子虫的形态特征, 同时18s rDNA序列比对结果显示, 该雷氏放射孢子虫为寄生于鲫鱼鳃软骨组织的Myxobolus cultus的对应放射孢子虫阶段。
1 材料与方法
1.1 实验材料
水栖寡毛类样品于2009年采自本实验室位于湖北省武汉市蔡甸区的鱼类遗传育种实验基地。采样地点: 以异育银鲫为主要养殖鱼类的土质池塘和水泥塘间的排水沟。
1.2 实验方法
水栖寡毛类的采集和物种鉴定 池塘底泥的采集使用1/16 m2良的彼得生(Petersen)采泥器, 池塘边缘水浅的地方可直接用铁锹挖取, 排水沟内的样品直接用小铲子挖取。底泥样品经60目的铜筛清洗后, 装入2000 mL的烧杯中运回实验室。在实验室内, 将容器内的泥沙水倒入白瓷盘内, 待泥沙沉淀后, 肉眼状态下用弯头镊子将白瓷盘内的水蚯蚓轻轻挑出, 放入直径为12 cm玻璃培养皿中。分别用单蒸水和双蒸水清洗3次之后, 置于超纯水中室温条件下暂养3—5d。水栖寡毛类物种的鉴定根据中国动物志分类手册和《中国小蚓类研究》进行鉴定[18]。
放射孢子虫的收集 参照Yokoyama, et al.[19]提供的方法, 将形态结构完整的水蚯蚓放入24孔细胞培养板中, 每个细胞培养孔内加2 mL的双蒸水。然后将细胞培养板放入4℃房, 每隔两天用Zeiss Axiovert 200立体显微镜检查一次, 观察放射孢子虫的释放情况。细胞培养板中的水每两天更换一次。当观察到有放射孢子虫释放出来时, 将该阳性细胞培养孔内的水收集至1.5 mL的离心管内, 离心收集放射孢子虫。
放射孢子虫的形态学测量 新鲜释放出来的放射孢子虫, 置于光学显微镜下放大倍数观察, 利用校准目镜测微尺(分划板)并参照Lom, et al.[20]提供的测量方法和标准进行形态学数据测量。图片用Nikon ECLIPSE 80i显微镜上配置的数码相机拍摄。
18S rDNA的PCR扩增 实验所用引物为鲁义善[3]设计的引物: myxoF(5′-CGCGGTAATTCCA GCTCCAGTAG-3′)和myxoR (5′-ACCAGGTAAGTT TTCCCGTGTGA-3′)。吸取新鲜释放的放射孢子虫,滴在经过高压灭菌处理的载玻片上, 置于倒置显微镜下, 用毛细玻璃管小心分离出单个虫体。经灭菌双蒸水洗3次, 每4个虫体为一组, 放入含3 μL灭菌水的PCR管中。13000—16000 r/m离心10s, 先加入5 μL的细胞裂解液, 再滴入10 μL的矿物油防止水分蒸发。将PCR管放置于PCR仪中55℃温育1h, 99℃热变性20min, 变性后将PCR管迅速放在冰上, 降至室温, 最后加入15 μL 的PCR反应液, 使最终的总反应体系为25 μL。每组设一管空白对照(用清洗过放射孢子虫的水作为空白对照)。PCR反应条件: 94℃ 预变性2min; 94℃变性1min, 53℃退火50s, 72℃延伸1min30s, 循环35次; 72℃末端加尾10min; 4℃暂存。PCR 扩增产物经1%琼脂糖凝胶电泳、回收、并克隆到pMD18-T 载体中, 转化DH5α大肠杆菌, 培养过夜, PCR 筛选阳性克隆, 测序。
细胞裂解液的配制(1000 μL 体系): 10×PCR buffer 100 μL; 25 mmol/L MgCl280 μL; 10 mmol/L proteinase K 30 μL; 灭菌水790 μL。
PCR反应液的配制: 10×PCR buffer 0.5 μL; MgCl2(25 mmol/L)1.4 μL; dNTP (10 mmol/L)0.5 μL;正向引物(10 μmol/L)1 μL; 反向引物(10 μmol/L)1 μL; Taq DNA polymerase 0.125 μL; 0.475 μL 灭菌水。
18S rDNA的序列分析 登录NCBI, 用BLAST-N程序 (http://blast.ncbi.nlm.nih.gov/)对测序结果进行同源性检索。使用Clustal-X进行序列的多重比对, 分析序列的一致性[21]。
2 结果
2.1 水栖寡毛类物种鉴定
水栖寡毛类经鉴定均为: 尾鳃蚓属(Branchiura)苏氏尾鳃蚓(Branchiura sowerbyi Beddard, 1892)。
2.2 放射孢子虫的释放
2009年采集的538条苏氏尾鳃蚓样品中, 仅有一条在4℃培养条件下的第8天释放出成熟的放射孢子虫。
2.3 放射孢子虫的形态描述
寄主苏氏尾鳃蚓体内释放出的放射孢子虫为雷氏放射孢子虫, 具有明显的“三支架”锚状形态, 随机选取其中15个新鲜虫体进行形态学观察和数据测量(表1)。雷氏放射孢子虫的整体形态结构(图1):主要由3个极囊(Polar capsule)、内含孢原质(Sporoplasm)的孢子体(Spore body)和3个尾突(Caudalprocesses)组成, 无孢柄。孢子体侧面观呈长椭圆形,平均长16.4 μm, 宽9.5 μm; 孢原质侧面观呈卵圆形; 3个大小均等的极囊位于孢子体顶端, 极囊呈梨形,平均长5.2 μm, 宽2.9 μm; 3个尾突基本等长, 平均长度为102.6 μm, 宽为4.7 μm; 尾突末端轻微的上翘。有趣的是, 当放大倍数观察时, 可明显见每个尾突的远侧端表面有许多细小的、形状不规则的棘状小刺, 靠近末端部尤为明显(图1C、D)
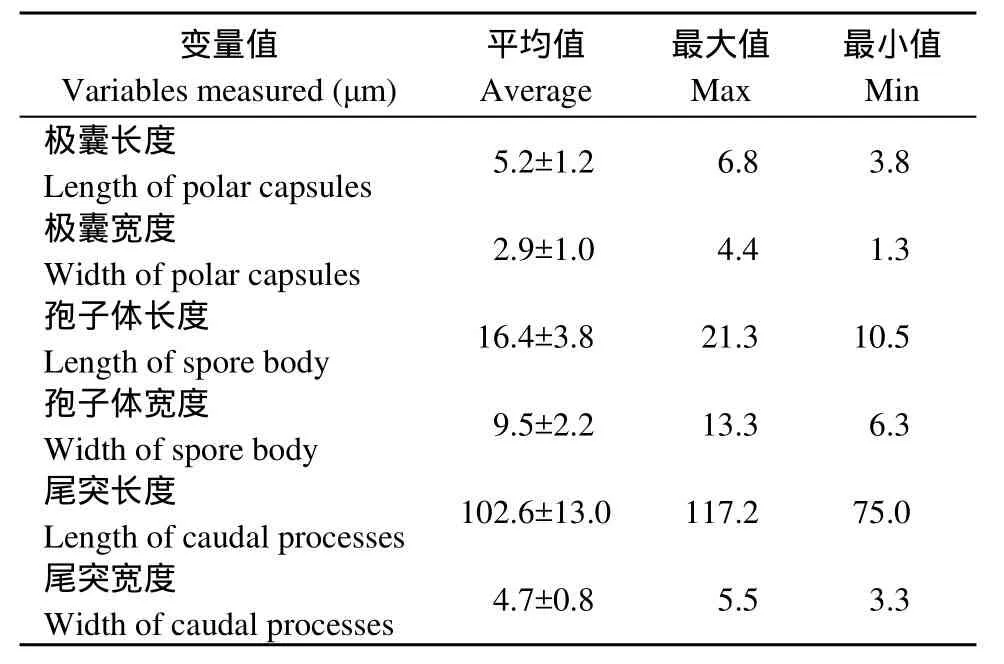
表1 雷氏放射孢子虫的形态学测量数据Tab. 1 Measurements of the live Raabiea type actinospore which released from oligochaete in present study (n=15)

图1 雷氏放射孢子虫的形态结构Fig.1 Morphological observation of Raabeia type actinospore
2.4 18S rDNA的序列分析
以放射孢子虫为模板, 利用引物myxoF和myxoR扩增到了长度为753 bp的18S rDNA序列。该雷氏放射孢子虫与国外报道的M. cultus (AB121146)序列一致性最高(98.41%); 与国内报道的Raabeia sp. BWX(HQ613408)和M. cultus (HQ613409)的一致性次之, 分别为98.26%和98.14%; 与国内报道的M. lentisuturalis (AY119688)之间一致性为96.55%。
2.5 小结
类型: 雷氏放射孢子虫 (Raabeia type)
寄主: 苏氏尾鳃蚓 Branchiura Sowerbyi Beddard 1892
采集地: 湖北, 武汉, 蔡甸区
感染率: 0.18%
在放射孢子虫类群的鉴定中, 孢子体的形状,孢柄的有无及尾柄形状特征等都是非常重要的鉴定依据。本文描述的放射孢子虫孢体呈椭圆形, 无孢柄, 尾柄近邻孢体后端向后侧延伸并稍微上翘, 呈典型的锚状形态。这些形态特征为雷氏放射孢子虫的主要特征, 因此我们将该放射孢子虫归为雷氏集合群(Raabeia collect group)。此外, 尾突末端放大倍数观察, 每个尾突的远侧端表面有许多形状不规则的棘状小刺, 此特征在所报道的雷氏放射孢子虫中是少见的(图1C、D)。
3 讨论
继Wolf和Markiw 的开创性工作之后, 作为黏孢子虫在中间宿主体内生活阶段的各类型放射孢子虫陆续地被研究者报道。在已报道的200多种放射孢子虫中(19个组合群), 雷氏放射孢子虫(Raabeia type)有29种, 占总数的14.5%。表2中列出了已报道的雷氏放射孢子虫[22—34]。当雷氏放射孢子虫随着寡毛类动物的粪袋排出体外进入水体后, 在水体内的锚状形态结构和无孢柄的特性使其与其他类型的放射孢子虫如桔瓣放射孢子虫(Aurantiactionmyxon)、合放射孢子虫(Synactionmyxon)和三突放射孢子虫(Triactinomyxon)等很容易区别开来。

本文描述的雷氏放射孢子虫与Hallett, et al.[32]报道的雷氏放射孢子虫 R. type 2的外观形态最为接近(表2), 两者之间尾突长度差距最小(102.6 μm vs. 120.7 μm), 只是R. type 2的孢子体较长较宽些(22 μm×14.2 μm vs. 16.3 μm×9.5 μm), 极囊近圆形,而本文报道的雷氏放射孢子虫极囊近梨形(4.2 μm×3.6 μm vs. 5.2 μm×2.87 μm)。另外, 当放大倍数观察尾突末端时, 可观测到尾突的远侧端表面有许多形状不规则的棘状小刺, Hallett, et al.[32]报道的雷氏放射孢子虫 R. type 2没有该特征。只有Özer, et al.[29]报道的雷氏放射孢子虫R. type 4的尾突后末端具有状小刺结构。但是, 与本研究鉴定的雷氏放射孢子虫相比, R. type 4的尾突较长(142.7 μm vs. 102.7 μm), 孢子体较大(29.6 μm×16.5 μm vs. 16.3μm×9.5μm),极囊也较大(6.3 μm×6.4 μm vs. 5.2 μm×2.87 μm), 而且孢子体形态偏圆形, 而本文报道的孢子体为椭圆形。
关于放射孢子虫尾突末端的不规则棘状物, 除了Özer, et al.[29]报道的雷氏放射孢子虫R. type 4之外, 在Marcucci, et al.[35]报道的棘放射孢子虫(Echinactinomyxon)和Hallett, et al.[36]报道的合放射孢子虫(Hexactionmyxon)中也有描述。Hallett, et al.的研究发现, 合放射孢子虫尾突末端的棘状物, 非常容易黏附培养基(或水体)中的碎片, 而且这种合放射孢子虫在静置状态下, 是沉于培养基底部的,在搅拌培养基后, 才会暂时地浮现于上层。因此Hallet, et al.认为, 放射孢子虫能利用尾突末端的棘突黏附水中杂物来增加自身重量, 降低在水体中的浮力, 不至于漂浮在水体的表面, 从而增大与水体中宿主鱼的接触机会, 增强感染宿主的几率[36]。作者认为, 尾突末端的不规则小棘突, 除了上述功能之外, 可能还有利于增强放射孢子虫与寄主体表的接触面积, 或者说当与寄主体表接触时, 棘突有利于孢子虫更好地黏附于寄主体表, 有利于原始感染性胚质细胞向寄主体内的释放。
除了形态特征比较的差异之外, 不同类型的雷氏放射孢子之间也存在寄主偏好性差异。从表2中还可以看出, 在已报道的29种放射孢子虫中, 有4种是寄生于颤蚓科(Tubificidae)的尾鳃蚓属(Branchiura), 分别是R. type of M. cultus[34]、R. type of M. lentisuturalis[33]、R. type 1 of EL-Mansy 和R. type 2 of EL-Mansy[27]。而其他种类的雷氏放射孢子虫则多寄生于颤蚓科的正颤蚓(T. tubifex)、霍甫水丝蚓(Limnodrilus hoffmeisteri)以及蠕虫(L. variegatus)。本文描述的雷氏放射孢子虫的寄主经鉴定为尾鳃蚓属的苏氏尾鳃蚓。
通过部分18S rDNA序列比对, 本文报道的雷氏放射孢子虫与国外研究报道的M. cultus (AB121146)和国内上传至NCBI上的M. cultus (HQ613409)的序列一致性都在98%以上。目前, 尽管还没有制订出广为接受的遗传距离标准与域值来明确区别种类间的界限范围, 但是, 从已发表的几篇研究论文来看,一致性在98%以上的, 基本被认定为同一物种, 其差异值是由于寄生于不同的寄主或地理位置不同所造成的[37—41]。Yokoyama, et al.[34]通过感染实验证实M. cultus的对应放射孢子虫为雷氏放射孢子虫,因此, 我们将本研究鉴定的雷氏放射孢子虫与Yokoyama, et al.报道的雷氏放射孢子虫R. type of M. cultus的形态结构进行比较: 两者之间最大的差别在于, 本文鉴定的雷氏放射孢子虫尾突末端有细小的棘突, 孢子体近椭圆形; 而R. type of M. cultus有较长的尾突(204 μm vs. 102.6 μm), 孢子体较长较窄(21 μm×8 μm vs. 16.3 μm×9.5 μm), 更接近于长圆形。Holzer, et al.的研究表明, 来源于不同寄主体内的放射孢子虫, 即使是基因型相同的同一物种, 为了适应不同的生长环境, 在表型上会存在少许的形态差异[42]。因此, 我们认为本文描述的雷氏放射孢子虫可能为M.cultus的对应放射孢子虫阶段。本研究丰富了国内放射孢子虫的基础研究。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!




