通讯:13983250545
微信:ycsh638
QQ:469764481邮箱:ycsh6318@163.com
论文:淡化对南美白对虾存活率、渗透压和Na+/K+-ATP酶活力的影响
淡化对南美白对虾存活率、渗透压和Na+/K+-ATP酶活力的影响
唐建洲1,2,3,刘臻1,2,汪星磊1,齐绍武3,柏连阳4,
张建昌2,张义2,刘勇虎1,刘正轩1
(1.长沙学院生物与环境工程系,长沙410003;2.常德家华水产科技有限公司,湖南常德415523;3.湖南农业大学,长沙410128;4.湖南省农业科学院,长沙410125)
摘要:采用微型冰点渗透压仪、荧光定量PCR和酶活力测定的方法分析淡化对南美白对虾(Penaeus vannamei)存活率、体内渗透压及Na+/K+-ATPase基因表达和酶活力的影响。结果表明,养殖水体盐度由12‰下降到0‰过程中,虾苗存活率和活力始终维持一个较高的水平。对虾体内渗透压随着水体盐度的降低而降低,但没有显著差异。渗透压调节关键基因Na+/K+-ATPase mRNA表达水平和酶活力在水体盐度12‰下降到9‰过程中显著升高,之后随着水体盐度的下降表达量显著降低,最后在6‰下降到0‰过程中趋于平缓。
关键词:淡化;南美白对虾(Penaeus vannamei);存活率;渗透压;Na+/K+-ATP酶
南美白对虾(Penaeusvannamei)具有适应盐度范围广、抗病力强、生长速度快、出肉率高、肉质鲜美、高蛋白低脂肪、适合于人工高密度养殖等特点,既可海养,也可淡养,是当今世界上公认的三大养殖对虾优良品种之一[1]。南美白对虾具有较强的渗透压自我调节能力,能在0~40‰的水体中正常生长,人们通常通过改变养殖水环境盐度实现南美白对虾在淡水环境中高效养殖[2-5]。卢光涛[6]研究了低盐环境下南美白对虾渗透压的变化规律,结果表明盐度突变(2‰→10‰),虾体血清渗透压水平显著上升,3 h时达到最大值,随后渗透压水平逐步显著下降,12 h时重新达到稳定;王文娟等[7]在低盐度下研究了不同蛋白含量饲料对南美白对虾渗透压调节的影响,结果揭示低盐环境下,虾体需要消耗蛋白质维持渗透压的稳定;郑德斌等[8]研究了环境溶解氧对南美白对虾渗透压变化的影响。此外,也有学者研究了甲壳类动物渗透压变化规律,如采用cDNA文库的方法对南美白对虾渗透压相关基因进行了分类研究,发现与渗透压相关基因主要为ATP酶基因、调节因子、能量代谢等基因[9-12]。尽管前人开展了盐度对对虾渗透压调节的研究,但是,南美白对虾由高盐度进入低盐度水体环境中,虾体渗透压调节的变化规律研究尚未见报道,因此,本实验研究不同盐度对南美白对虾存活率、渗透压及其渗透压调节相关的Na+/K+-ATPase的基因表达和酶活力的变化规律,以期揭示南美白对虾渗透压调节机理,为人工配制南美白虾渗透压调节剂的研究与应用提供理论基础。
1材料与方法
1.1实验条件
实验在0.2 m3的玻璃水族箱内进行,实验用水为淡水。初期使用渗透压调节剂按实验设计调节水体盐度为12‰,pH 8.6,水温控制在(26±2)℃,24小时连续曝气。
1.2实验材料
南美白对虾虾苗(SPF虾苗)由海南禄泰公司提供,规格整齐、大小一致,体长约0.2 cm。
1.3实验方法
1.3.1实验设计与取样
实验设空白及对照组,各组重复3次,虾苗进缸前3 d将所用水体盐度调成12‰,pH8.6。每一水族箱放置规格一致的虾苗1 000尾进行实验,实验时间为水体从12‰淡化至0‰度为止,淡化时盐度每天降低1.5‰,共8 d。分别在水体盐度为12‰,9‰,6‰,0‰时取样,测定各取样点水体渗透压、虾苗存活率和活力、全虾渗透压、Na+/K+-ATPase表达量及酶活力。实验过程中每天投饵6次,日投饵量为虾体重的5%~8%,视摄食情况进行调整。每天观察记录虾体的摄食、活动及死亡情况,定期进行吸污、换水和施药防病等工作。
1.3.2虾苗活力检测
具体测定方法参照廖永岩等[13]。活力情况分为三个等级:差、一般、好。一个水族箱有50% ~ 80%的虾苗对外界刺激反应灵敏,游泳时有明显的方向性,静憩时头部高昂,步足和腹肢支撑有力,尾扇张开,则活力一般;若有80%以上,则活力为好;若在50%以下,则活力为差。
1.3.3渗透压测定方法
因虾苗长度只有0.2 cm,所以每组取相同质量的全虾,低温匀浆,用去离子水稀释到0.5 mL,10 000 r/min冷冻离心10 min,吸取上清液,采用Fiske 210微型冰点渗透压仪测定渗透压。
1.3.4Real-time PCR 检测基因表达
将全虾用液氮研磨,使用Invitrogen公司的Trizol试剂盒进行总RNA提取。用核酸蛋白仪进行定量分析及纯度鉴定,1.5%琼脂糖凝胶电泳鉴定其完整性,-80 ℃保存备用。使用Invitrogen公司的反转录试剂盒进行RT-PCR扩增。实时荧光定量PCR 按照Real Master MIX (SYBR Green)试剂盒(ABI 公司)说明书进行操作,同时设置无模板阴性对照,采取两步PCR 法,95 ℃预变性10 s,95 ℃变性10 s,60 ℃复性1 min,40个循环,扩增引物为β-actin F/R (5′-TGACGGAGCGTGGCTACAC-3′,5′-CCACGTCGCACTTCATGATG-3′)和Na+/K+-ATPase F/R (5′-AAGGCTGGAAGGCTCTGTCT-3′,5′-GGGTCGTTCTTATCCTCGGT-3′)。反应在Agilent Stratagene MX3005P 荧光定量PCR 仪上进行,数据采用2-△△CT方法分析[14]。
1.3.5Na+/K+- ATPase活力测定方法
酶液制备:取相同质量的全虾,用预冷的蒸馏水(0~4 ℃)洗净、滤纸吸干后置于5 mL冰冷酶提取液(0.25 mmol/L蔗糖,6 mmol/L EDTA-Na2,10 mmol/L Tris,0.1%脱氧胆酸钠,pH 7.5)中,匀浆5 min,10 000 r/min冷冻离心30 min,吸取上清再离心10 min,将所得上清液冷藏保存,8 h内测定Na+/K+-ATPase活力。
酶活力测定:酶蛋白含量采用Bradford(1976)方法[15]测定。Na+/K+-ATPase活力测定采用南京建成超微量试剂盒(A070-2)进行测定。以每小时每毫克蛋白中ATP酶分解ATP产生1 μmol 无机磷的量为一个ATP酶活力单位来计算,酶活力单位为微摩尔无机磷每毫克蛋白小时[μmol Pi/(mg pr·h)]表示。
1.4数据处理与分析
试验数据采用SPSS statistics 17.0统计软件包用单因素方差分析(One-way ANOVA)的方法进行显著性检验,并进行组间多重比较。试验数据用平均数±标准差表示。
2结果与分析
2.1水体盐度与对虾苗存活率和活力的影响
由表1可知,养殖水体盐度由12‰下降到0‰过程中,存活率始终维持较高的水平,在盐度0‰仍能达到90.5%。盐度的降低对虾苗的活力影响并不大,在整个淡化过程中,虾苗的活力较好。虾苗对水体盐度的变化能够较好适应。
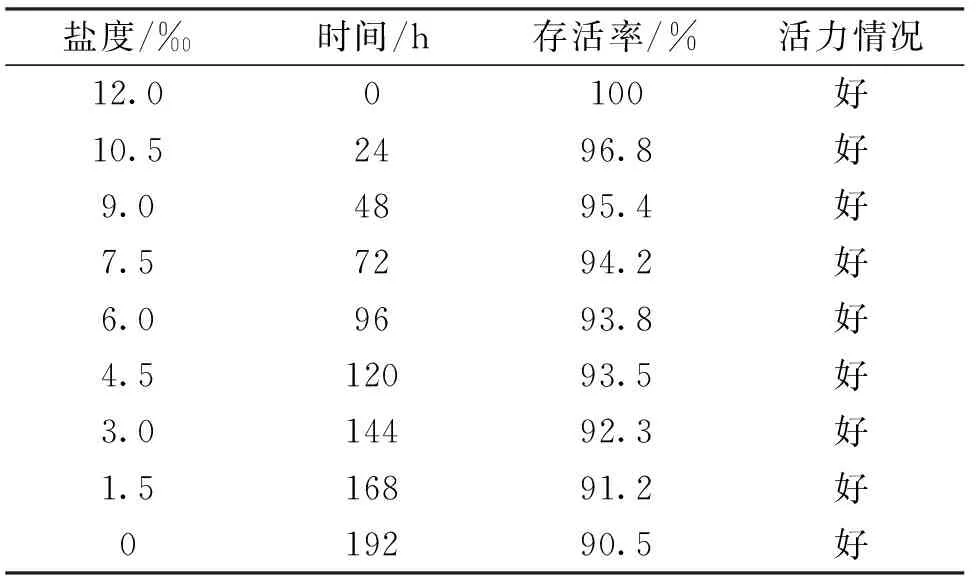
表1 淡化对南美白对虾虾苗存活率和活力的影响
2.2水体盐度与水体渗透压、虾体渗透压的关系
由图1可知,养殖水盐度由12‰下降到0‰过程中,虾苗渗透压表现出随盐度下降而下降的趋势。12‰下降到9‰时,虾体渗透压下降坡度较大,趋势明显; 9‰下降到0‰的过程中,下降坡度趋于平缓,虾体渗透压变化不大。养殖水体渗透压与盐度变化基本成线性关系,而虾苗渗透压曲线与水体盐度变化没有一定的线性关系,两条曲线的焦点即为南美白对虾虾苗的等渗点,此时水体盐度为8‰左右,渗透压约380 mOsm,说明虾苗水体盐度对全虾渗透压有影响,但不明显。
2.3水体盐度与虾体渗透压调节相关基因Na+/K+-ATPase表达水平的关系
当水体盐度由12‰下降至9‰时,Na+/K+-ATPase mRNA表达水平急剧上升,差异显著(P<0.05),但水体盐度进一步降低至6‰时,表达量显著下降(P<0.05);水体盐度由6‰下降到0‰时基因表达继续下调,且在0‰表达量达到最低(图2)。

图1 不同盐度下虾体渗透压

图2 不同盐度下Na+/K+-ATPase基因的表达水平
(注:a,b,c表示基因表达水平的是否有显著差异,相同字母之间没有差异,不同字母之间有显著差异)
2.4水体盐度与Na+/K+-ATPase活力高低的关系
由图3可知,养殖水体由12‰下降到0‰过程中,渗透压相关最主要酶Na+/K+-ATPase活力的变化与基因表达呈相同的趋势。在水体盐度由12‰下降到9‰时,酶活力上升,在9‰下降到0‰过程中,先下降,后呈平稳趋势;其中在水体盐度为9‰时活力最高,与其他盐度下相比差异显著(P<0.05)。

图3 不同盐度下Na+/K+-ATPase的活力
(注:a,b,c表示基因表达水平的是否有显著差异,相同字母之间没有差异,不同字母之间有显著差异)
3讨论
南美白对虾是广盐性的虾类,具有较强的渗透压自我调节能力,能适应在淡水中生活[13]。研究表明,养殖水体盐度由12‰下降到0‰过程中,南美白对虾幼苗的存活率较高,活力始终维持一个较高的水平。这与廖永岩等[13]研究淡化对凡纳滨对虾幼体存活和活力影响的结果一致,暗示了南美白对虾对淡化过程中盐度的变化有一个很好的适应过程。
已有研究表明,南美白对虾能在低盐甚至淡水环境中正常生长,是因为其具有较强的渗透压自我调节能力[2-5]。本研究观察到南美白对虾虾体的渗透压在水体渗透压变化的过程中没有直接相关性,虽然有一定的波动,但是影响不大,这可能与虾体对于自身渗透压的调节有关。Huong等[16]研究低盐对渗透离子调节影响时发现,极低盐度下(0.5和1)南美白对虾渗透压变化很快,说明虾苗在低盐时的渗透压调节能力很强。水体盐度的变化对虾体渗透压影响不大,这可能是南美白对虾适应淡水生存的主要原因。
渗透压调节可分成细胞内和细胞外调节,分别由不同的渗透压调节因子进行调节。细胞内主要靠有机离子来调节,其中又以游离氨基酸占绝大部分,而细胞外渗透压主要靠血液、淋巴中无机离子来调节,如Na+,K+等,可能与渗透压调节相关基因的表达及Na+/K+-ATPase活力有关[17]。南美白对虾在低盐度(12‰以下)下变化过程中,具有很强的调节能力,这可能与细胞内和细胞外调节因子都有一定的联系。
在南美白对虾中,很多基因参与渗透压调节,其中最为重要的调节基因是各种离子转运酶。在甲壳动物中离子转运的酶包括Na+/K+-ATPase、V-ATPase和HCO3-ATPase和碳酸酐酶(Carbonic anhydrase,CA)等[18],其中Na+/K+-ATPase活力占转运酶活力的70%[21],大量研究表明水体盐度变化会导致甲壳动物体内Na+/K+-ATPase活性的显著变化,盐度是激发南美白对虾渗透压调节的最主要环境因素[19-22]。南美白对虾虾苗经海南运入长沙实验基地后,水体盐度保持育苗时的盐度,即12‰。为适应湖南本地的淡水养殖,需进行虾苗淡化,以适应当地淡水,所以本实验从水体12‰盐开始淡化。当水体盐度由12‰下降到9‰时,Na+/K+-ATPase基因表达水平及酶活力呈上升趋势,可能是虾苗为适应水体盐度变化的一种“应激反应”,以适应当前的水体盐度变化;当水体盐度进一步下降时,Na+/K+-ATPase表达水平和酶活力又缓慢下降,逐渐平缓,并保持在一定水平,可能是适应了淡水水体的渗透压。与其它研究结果一致,盐度变化会影响甲壳动物离子转运酶活性,偏离等渗点时,不管是降低盐度或是升高盐度,离子转移酶活力都会不同程度地升高,且低盐度水体下,南美白对虾Na+/K+-ATPase活力较高[23]。
综上所述,南美白对虾对低盐环境的耐受力较强,Na+/K+-ATPase可能在低盐胁迫过程中对南美白对虾体内渗透压的调节发挥着关键的作用。
参考文献:
[1]邬国民.南美白对虾养殖技术(上)[J].科学养鱼,2000,(8):8-9.
[2]丁理法,李利卫,江海华.南美白对虾健康高效养殖技术[J].中国水产,2005,(7):42-45.
[3]窦华杰,顾行发,李均发,等.南美白对虾淡水养殖试验[J].天津水产,2001,(4):27-29.
[4]裴春生.南美白对虾淡水养殖技术[J].中国科技投资,2013,(14):195.
[5]杨雪,张平,郭程序.浅谈南美白对虾淡水高产养殖技术[J].农民致富之友,2014,(14):270.
[6]卢光涛.低盐环境对凡纳滨对虾渗透生理、胴体品质的影响[D];武汉:华中农业大学,2008.
[7]王文娟,迟淑艳,谭北平,等.低盐度下不同蛋白含量的饲料对凡纳滨对虾生长、体成分、渗透调节的影响[J].饲料与畜牧,2012,(4):33-36.
[8]郑德斌,潘鲁青,金彩霞.溶解氧对凡纳滨对虾血淋巴血蓝蛋白、渗透压和鳃丝离子转运酶活力的影响[J].中国海洋大学学报(自然科学版),2010,(11):35-38.
[9]冯广朋.盐度对中华绒螯蟹雌性亲蟹渗透压调节和酶活性的影响[J].海洋渔业,2013,35(4):468-473.
[10]周双林,姜乃澄.甲壳动物渗透压调节的研究进展Ⅱ.排泄器官的结构与功能[J].东海海洋,2004,(4):31-37.
[11]Liu H Y,Pan L Q,Zheng D B.Injection of biogenic amines modulates osmoregulation ofLitopenaeusvannamei:response of hemolymph osmotic pressure,ion concentration and osmolality effectors[J].Comp Biochem Physiol Part A,Mole Integrat Physiol,2008,151(2):191-197.
[12]Goncalves-Soares D,Seiffert W Q,Schlindwein A D,et al.Identification of differentially transcribed genes in shrimpLitopenaeusvannameiexposed to osmotic stress and challenged with WSSV virus[J].Comp Biochem Physiol Part D,Genom proteom,2012,7(1):73-81.
[13]廖永岩,钟导宏.淡化速度和幅度对凡纳滨对虾幼体存活和活力的影响[J].海洋通报,2004,23(1):58-63.
[14]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[15]Zhao Q,Shao L,Hu X,et al.Lipoxin a4 preconditioning and postconditioning protect myocardial ischemia/reperfusion injury in rats[J].Mediat Inflammat,2013,(4):1-13.
[16]Huong D T,Yang W J,Okuno A,et al.Changes in free amino acids in the hemolymph of giant freshwater prawnMacrobrachiumrosenbergiiexposed to varying salinities:relationship to osmoregulatory ability[J].Comp Biochem Physiol Part A,Mole Integrat Physiol,2001,128(2):317-326.
[17]J Shah,H S Sachdev,T Gera,et al.Osmoregulation in the muscle fibers of Carcinus maenas[J].J Exp Ecol,1955,35(4):1215-1216.
[18]Morris S.Neuroendocrine regulation of osmoregulation and the evolution of air-breathing in decapod crustaceans[J].J exp Biol,2001,204(5):979-989.
[19]Mendonca N N,Masui D C,McNamara J C,et al.Long-term exposure of the freshwater shrimpMacrobrachiumolfersiito elevated salinity:effects on gill (Na+,K+)-ATPase alpha-subunit expression and K+-phosphatase activity[J].Comp Biochem Physiol Part A,Mole Integrat Physiol,2007,146(4):534-543.
[20]潘鲁青,刘泓宇.甲壳动物渗透调节生理学研究进展[J].水产学报,2005,(1):109-114.
[21]Li J,Ma P,Liu P,et al.The roles of Na/K-ATPase alpha-subunit gene from the ridgetail white prawnExopalaemoncarinicaudain response to salinity stresses[J].Fish Shellf Immunol,2015,42(2):264-271.
[22]Wang Y,Luo P,Zhang L,et al.Cloning of sarco/endoplasmic reticulum Ca(2+)-ATPase (SERCA) gene from white shrimp,Litopenaeusvannameiand its expression level analysis under salinity stress[J].Mole Biol Report,2013,40(11):6213-6221.
[23]Rosas C,Sanchez A,Diaz E,et al.Effect of dietary protein level on apparent heat increment and post-prandial nitrogen excretion ofPenaeussetiferus,P.schmitti,P.duorarum,andP.notialispostlarvae[J].J World Aquacult Soc,1996,27(1):92-102.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!




